A piracetam (Nootropil) széleskörűen alkalmazott nootropikum, melyet gyakran adnak intravénásan. Két páciensünk kis mennyiségű Nootropil infúzióval kontaminálódott mintájánál az átlagos vörösvérsejt térfogat (mean cell volume - MCV) jelentős növekedése volt megfigyelhető. A jelenséget hat különböző hematológiai automatán (Cell-Dyn 3500, Cell-Dyn 3200, Cell-Dyn 4000, Technicon H3, Coulter STKS, és Sysmex SF 3000) és a mikrohematokrittal összevetve vizsgáltuk. Ennek során az MCV növekedése dózisfüggőnek bizonyult, melyet a centrifugált hematokrit értékének növekedése is követett. Az MCV növekedése már a terápiás tartományban és in vivo is kimutatható, ozmotikus eredete pedig kizárható volt.
A hat vizsgált hematológiai analizátor közül csak a Sysmex SF-3000 nem volt képes - mérési elvéből következően - a sejtek térfogatának változását detektálni. Ugyanakkor a Cell-Dyn 3500 a valóságosnál nagyobb mértékű MCV emelkedést jelzett - feltehetően a vörösvérsejtek megváltozott deformabilitására visszavezethetően.
Az eredmények azt mutatják, hogy a piracetam hatására a vörösvérsejtek valós duzzadása jön létre. A különböző hematológiai automaták eltérő mérési eredményei ugyanakkor némely analizátor típus MCV mérésének korlátozott linearitására hívják fel a figyelmet.
A piracetam (Nootropil) neuroprotektív hatású nootropikum, amelyet széleskörűen használnak cerebrovaszkuláris kórképek kezelésében (1,2) és kedvező hatásúnak bizonyult sarlósejtes anémiában is. Hatására vonatkozóan általánosan elfogadott mechanizmus nem ismeretes. A gyógyszert gyakran alkalmazzák intravénásan, egyes esetekben igen nagy koncentrációban (24-30 g/nap) is.
Két Nootropil infúzióval kezelt páciensünk mintája esetén az átlagos vörösvérsejt térfogat (mean cell volume - MCV) és a hematokrit jelentős mértékű növekedését figyeltük meg Abbott Cell-Dyn 3500 hematológiai analizátorunkon. Az eltérés hátterében mindkét esetben a vénás kanülből nem megfelelő módon levett vér állt, amely az infúzióval kontaminálódott. Az analizátoron mért MCV és hematokrit növekedésével párhuzamosan a centrifugált hematokrit (mikrohematokrit) értéke is növekedett, de ennek mértéke nem érte el az analizátor által mért MCV növekedés mértékét.
A klinikai laboratóriumokban általánosan használják a hematológiai automatákat, melyek alkalmasak a vér sejtjeinek pontos és megbízható számlálására, mérésére és osztályozására. A hematológiai analizátorokkal nyert MCV jelentős segítséget nyújt az anémiák osztályozásához és kiváltó okuk felderítéséhez. Ezenkívül, mivel a hematokrit és az átlagos vörösvérsejt hemoglobin koncentráció (MCHC) is az analizátorok által mért MCV értékén alapszik, ezek pontossága is az MCV egzakt mérésétől függ. Az automatizált hematológiai méréseknél jól ismert a súlyos hiperglikémiánál fellépő ozmotikus mátrix hiba (3,4,5,6,7), mely azonban nem jár a centrifugált hematokrit változásával. A centrifugált hematokrit növekedése arra utal, hogy a piracetam a vörösvérsejtek tényleges duzzadásához vezet, és nem az analizátoron belüli ozmózisra vezethető vissza.
A vörösvérsejtek piracetam hatására kialakuló duzzadása klinikailag komoly jelentőséggel bír, amennyiben magyarázatot adhat a szer sarlósejtes anémiában megfigyelt kedvező hatására (8,9,10,11). A jelentős eltérés az automata által mért MCV és a centrifugált hematokritból és a vörösvérsejtszámból számolt MCV-érték között a mérés során fellépő technikai hibára utal. A jelenség mechanizmusának és gyakorlati jelentőségének felderítésére hat különböző hematológiai automatán végeztünk vizsgálatokat.
Analizátorok
Abbott Cell-Dyn 3500. A Cell-Dyn 3500 hematológiai analizátor a vörösvérsejtek számlálását és térfogatának meghatározását impedancia-elven végzi. A vörösvérsejtek mérése során a hidrodinamikusan fókuszálás nélkül áramló sejteknek a mérési zónába történő visszaáramlását az apertúra után elhelyezett von Behrens lemez gátolja meg. A készülék a mintát izotóniás (310 mosmol/kg) diluenssel (Diaton-CD 3.0/3.5; Diagon Kft.) hígítja, mely sem fixáló, sem a sejteket gömbölyítő adalékanyagot nem tartalmaz.
Abbott Cell-Dyn 4000. A Cell-Dyn 4000 a vörösvérsejtek és thrombocyták számlálását és méretük eloszlásának analizálását nagyfelbontású fókuszált áramlású impedancia módszerrel végzi, mellyel párhuzamosan a sejteket optikai csatornán is megszámlálja. A hígító/köpeny reagens (Diluent/Sheath-CD 4.0, Abbott Laboratories Magyarország Kft. illetve Diaton/Sheath-CD 4.0, Diagon Kft.) izotóniás (308 mosmol/kg), és a sejteket számlálásukat és mérésüket megelőzően izovolumetriásan gömbölyítő detergenst tartalmaz, de fixálószert nem.
Abbott Cell-Dyn 3200. A Cell-Dyn 3200 a vörösvérsejtek számlálását és méretük meghatározását a rajtuk szóródó lézerfény két dimenziós feldolgozásával végzi. A sejteket a mérést megelőzően izovolumetriásan kigömbölyíti és hidrodinamikusan fókuszálja a hígító/köpeny reagenssel. A diluens (Diaton/Sheath-CD 3.2, Diagon Kft.) közel megegyező a Cell-Dyn 4000 által használttal.
Sysmex SF-3000. A vörösvérsejt és thrombocyta jellemzőket apertúra-impedancia elven határozza meg, a mérés során a sejteket hidrodinamikusan nem fókuszálja. A készülék hipoozmotikus (252 mosmol/kg) diluense (Diaton-Sys Diluent, Diagon Kft.) nem tartalmaz a sejteket gömbölyítő detergenst vagy fixálószert, hanem a sejteket ozmotikus úton duzzasztja a mérés előtt gömb formájúvá.
Coulter STKS. A készülék a mérést a hagyományos Coulter-elven végzi. Ennek során a vért hígítja, 10,5 másodpercig inkubálja, majd három egymást követő 4 s-os időintervallumban méri, mely intervallumok között fél másodperces szünetek vannak. Az MCV-t a készülék a három intervallumban meghatározott értékekből számolja. A készülék diluense (Diaton CT-Diff. Diluent, Diagon Kft.) izotóniás (305 mosmol/kg), nem tartalmaz a sejteket gömbölyítő detergenst, de tartalmaz egy monoaldehid-emitten (1,3 Bis(hidroximetil)-5,5dimetil-hidantoin), mint fixálót.
Technicon H3. A H3-as a vörösvérsejtek és thrombocyták számát és térfogatát áramlási cytometriás fényszórás-méréssel határozza meg. A sejteket az izozmotikus (285 mosmol/kg) diluens (RBC/PLT Diluent, Diagon Kft.) - mely detergensként nátrium-dodecil-szulfátot (SDS) és fixálóként glutáraldehidet tartalmaz - izovolumetriásan gömbölyíti és fixálja, majd hidrodinamikusan fókuszálja. A vörösvérsejtek nagyságának meghatározása két különböző szögbe szórt fény mérésével történik, mely így kivédi a sejtek hemoglobin koncentrációjának variációjából származó, a sejtek térfogatának meghatározásánál zavaró hatást.
A hematokritot valamennyi készülék a vörösvérsejtszámból és az MCV-ből számítja.
A centrifugált mikrohematokritot a standard módszerrel, egy Hettich Hematokrit centrifugával határoztuk meg 13000 rpm fordulatszámmal 7 percig történő centrifugálással.
Minták kiválasztása és gyűjtése
A normo-, mikro- vagy makrocyter teljesvér mintákat a laboratóriumba küldött rutin mintákból válogattuk. A mintákat zártrendszerű 3 ml-es, 2EDTA-t (1,8 mg/ml) tartalmazó vákuumos vérvételi csövekbe (Vacutainer Plus, Becton Dickinson, Csertex Kft.) nyertük, és a mintavételtől számított 2 órán belül elvégeztük meghatározásukat a hematológiai automatákon.
A piracetam hatása az MCV mérésre
1 ml EDTÁ-s vérhez 500 µl ozmotikusan indifferens, acetát-pufferolt piracetam-oldatot (Nootropil infúziós oldat 12 g/60 ml, (UCB Magyarország Kft.), melyet előzőleg desztillált vízzel 290 mosmol/kg H2O koncentrációjúra hígítottunk), illetve kontrolként izotóniás sóoldatot (290 mosmol/kg H2O) adtunk.
Az inkubációs idő hatása, reverzibilitás vizsgálata és dózis-hatás görbe
Az inkubációs idő hatásának vizsgálata céljából a piracetammal kezelt mintáknál a kezelést követően percenként meghatároztuk az MCV értékét. Miután a sejtduzzadás elérte a maximumát, a sejteket kétszer mostuk és reszuszpendáltuk izotóniás sóoldatban, majd újra meghatároztuk az MCV értékét.
A jelenség dózisfüggésének vizsgálata céljából 200 µl EDTÁ-val alvadásgátolt vérhez különböző (0, 5, 10, 15, 20, 30, 50, 75, 100 µl izotóniásra hígított piracetam-oldatot adtunk, majd az így kezelt minták térfogatát fiziológiás sóoldattal 300 µl-re egészítettük ki.
A diluens összetételének hatása a Cell-Dyn 3500 hematológiai analizátoron
A Cell-Dyn 3500 hematológiai automatán mért, a valósnál nagyobb mértékű MCV-növekedés okának vizsgálata céljából a következő kísérletet végeztük el:
A Diaton-CD 3.0/3.5 diluenshez adtunk 24,3 µmol/l nátrium-lauril-szulfát detergenst (SDS, SigmaAldrich Kft., Budapest), illetve fixálószert (6,5 µmol/l 1,3-bisz(hidroximetil)-5,5-dimetil-hydantoin (Lonza Inc., New Jersey), vagy mindkettőt, és a módosított diluensekkel is elvégeztük a mérést az eredeti, a piracetammal kezelt, valamint a fiziológiás sóval hígított mintákból. A detergens és a fixálószer alkalmazott koncentrációi megegyeztek azzal, amelyet a Cell-Dyn 4000 esetében a Diluent/Sheath-CD 4.0, illetve a Coulter STKS által használt Diaton CT-Diff. diluens tartalmaz, és a feltüntetett mennyiségben történő alkalmazásuk lényegében nem változtatta meg a diluens ozmolalitását sem.
A készüléket egyebekben a rutin használattal egyezően, a gyártó utasításainak megfelelően működtettük úgy, hogy a módosított diluenst az eredetivel egyező módon csatlakoztattuk az analizátorhoz.
A piracetam infúzió hatása az MCV-re és MCHC-re in vivo
Azért, hogy a piracetam indukálta vörösvérsejt-duzzadás klinikai jelentőségét és mértékét terápiás gyógyszer-koncentrációk esetén megítélhessük, a következő kísérletet végeztük el:
20 páciensnél, akik kórházba kerülésük után 12 g/nap piracetamot kaptak intravénásan, a páciensek felvételekor, tehát a kezelést megelőzően levett mintát, valamint másnap a piracetam infúzió beadását követően 15 perccel az ellenkező oldali karból vett mintát is megmértük a Cell-Dyn 3500 hematológiai analizátoron. A páciensek a vizsgálat ideje alatt nem kaptak transzfúziót.
Az adatok statisztikai feldolgozásához a Student-féle egymintás t-próbát használtuk.
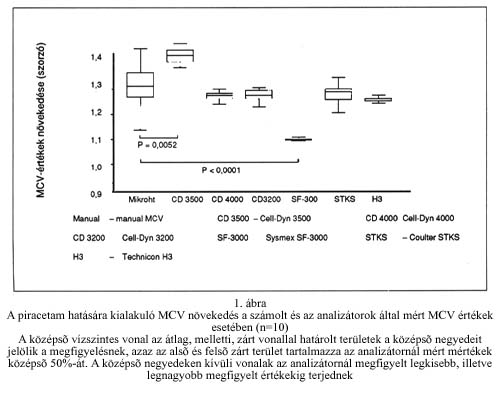
Az alkalmazott piracetam koncentráció hatását az automaták MCV-mérésére és a centrifugált hematokritból számolható MCV értékére az 1. ábra mutatja. Az automaták többsége a centrifugált hematokrit növekedésével közel egyező mértékű MCV növekedést mért, függetlenül az analizátor mérési elvétől (impedancia vagy lézerfény-szórás). A Coulter STKS három párhuzamos mérése között nem mutatkozott szignifikáns eltérés. A vörösvérsejtek méretének növekedése azonos arányú volt a különböző méretű (normo-, micro- vagy macrocyter) vörösvérsejtek esetében. Két automatánál tapasztaltunk jelentős eltérést a centrifugált hematokrit növekedésének mértékétől:

A Sysmex SF-3000 nem detektálta a sejtek térfogatának növekedését, aminek az oka, hogy a készülék a vörösvérsejteket a mérést megelőzően a hipotóniás diluensben a membránjuk mérete által megszabott mértékig duzzasztja, tehát ez a készülék tulajdonképpen a vörösvérsejtek membránjának méretét határozza meg, amely nem változik a piracetam hatására.
A Cell-Dyn 3500 hematológiai analizátor éppen ellenkezőleg, a sejtek méretének a valósnál lényegesen nagyobb mértékű növekedését mutatta. Ez az analizátor az egyetlen, melynek diluense nem tartalmaz sem detergenst, sem fixálószert és ozmotikus úton sem gömbölyíti a sejteket. Mivel a vörösvérsejtek méretét azonos elven meghatározó Coulter STKS analizátornál nem tapasztaltunk lényeges eltérést a centrifugált hematokritból számolható MCV értékektől, felvetődött, hogy esetleg a diluens oldat megváltoztatásával korrigálható a Cell-Dyn 3500 analizátornál tapasztalt eltérés.
A diluens összetételének szerepét vizsgálandó, a diluenshez annyi fixálószert adtunk, amennyit a Coulter STKS diluense tartalmaz és/vagy annyi a sejteket gömbölyítő hatású detergenst, amennyi a Cell-Dyn 4000 diluensében van. A rendszert nem kalibráltuk a különböző diluensekkel. Ez magyarázza a kis mértékű (-1%) MCV csökkenést a fixálót tartalmazó, és a szignifikáns (-14-16%) MCV növekedést a SDS-tartalmú diluenssel. A piracetam-kezelt mintáknál mérhető MCV növekedés mértéke nem változott a fixálószer hatására, de csak 25% volt a Diaton-CD 3.0/3.5+SDS diluenssel mérve, és mindössze 23% a fixálószert és a sejteket gömbölyítő detergenst is tartalmazó diluens használata során.
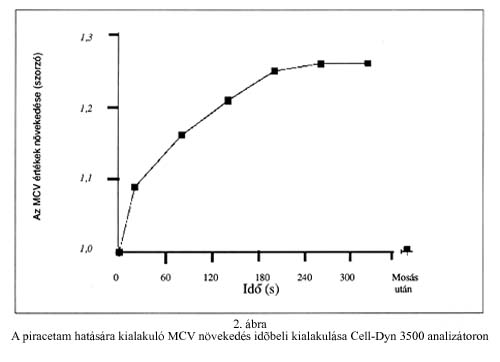
A sejtek duzzadásának időbeli lefutását vizsgálva (2. ábra), azt tapasztaltuk, hogy az már 5 perces inkubáció után eléri a maximumot, és ezután tartósan ezen az értéken marad. Izotóniás sóoldattal kétszer mosva a vörösvérsejteket, az MCV közel az eredeti értékre csökkent.
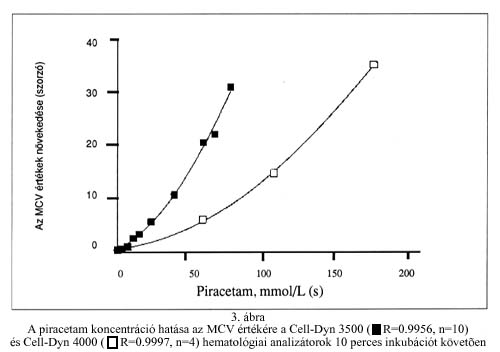
A Cell-Dyn 3500 és Cell-Dyn 4000 analizátorokon a piracetam koncentrációjának emelésével az MCV exponenciálisan növekedett. A koncentrációfüggés mindkét készülék esetében igen jól illeszkedő parabolikus görbével volt jellemezhető (3. ábra).
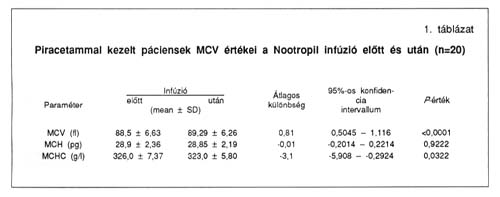
Az intravénásan adott piracetam in vivo hatását a páciensek mintáiból mérhető MCV és MCHC értékekre az 1. táblázat mutatja. A második infúzió után levett mintákból átlagosan 1%-kal nagyobb MCV értékeket kaptunk, mint az első infúzió beadása előtt levett mintákból. Ezt az MCHC értékek ellenkező irányú változása követte, miközben az átlagos vörösvérsejt hemoglobin (MCH) értékek között nem volt szignifikáns eltérés.
Eredményeink azt mutatják, hogy a vérmintákhoz adott piracetam hatására a vörösvérsejtek valóban megduzzadnak. A Sysmex SF-3000 nem volt képes ezt a duzzadást detektálni, a készülék által alkalmazott hipoozmotikus diluens a mérést megelőzően kifejtett ozmotikus duzzasztó-kigömbölyítő hatása miatt, melynek következtében a készülék tulajdonképpen a sejt membránjának nagyságát határozza meg, amely a piracetammal kezelt sejtek esetében nem változott.
A Cell-Dyn 3500-as analizátor által tévesen nagymértékűnek talált MCV növekedés oka nem egyértelmű. Lehetséges magyarázat lehet a sejtek alakjának változása és megnövekedett deformabilitásuk. Ismert, hogy azoknál a hematológiai analizátoroknál, melyek impedancia elven, de hidrodinamikus fókuszálás nélkül határozzák meg a vörösvérsejtek méretét, a sejtek deformabilitása (12) és alakja (1~3) hatással van a mérés eredményére. A deformabilitás lehetséges szerepe mellett szól az is, hogy már viszonylag kis mennyiségű fixálószer és a sejteket gömbölyítő hatású detergens lényegesen csökkentette az analitikai hibát. A Cell-Dyn 3500-nak a Coulter készülékhez viszonyított nagyobb érzékenységét más különbség hiányában a Cell-Dyn készülékben használt von Behrens lemez magyarázhatja, melynek eredeti feladata a vörösvérsejtek recirkulációjának csökkentése.
A piracetam-indukálta vörösvérsejt duzzadás mechanizmusa ismeretlen, de a centrifugált hematokrit növekedése kizárja annak ozmotikus eredetét. Asakura és munkatársail (14) szintén beszámolnak arról, hogy az in vitro nagy koncentrációjú (300-600 mM) piracetammal kezelt vörösvérsejteknek mind az átmérője, mind a térfogata megnövekedett, de ennek koncentrációfüggését nem vizsgálták, és a nagy koncentrációk miatt a jelenségnek terápiás szempontból nem tulajdonítottak jelentőséget.
Az MCV, az MCH és az MCHC, mint a vörösvérsejtekre jellemző paraméterek mentesek a diurnális ingadozásoktól (15). A piracetam infúzióval kezelt pácienseknél in vivo megfigyelhető MCV növekedés azt mutatja, hogy a piracetamnak a vörösvérsejtek duzzadását kiváltó hatása már a gyógyszer terápiásan alkalmazott koncentrációiban, in vivo is érvényesül. Ez a jelenség is magyarázhatja a piracetamnak a sarlósejtes anémiás páciensek kezelése során megfigyelt kedvező adjuváns hatását, melyet korábban az vörösvérsejt-endothel adherencia gátlásának (16), és a szernek a vörösvérsejtek deformabilitását fokozó hatásának tulajdonítottak (11,16,17).
Telített hemoglobin S oldatban a HbS polimerizációját a piracetam csak nagyon nagy koncentrációkban - jóval a terápiás tartomány felett - gátolta közvetlen módon (14). újabb vizsgálatok azonban azt mutatják, hogy a polimerizáció nagyon kifejezett érzékenységet mutat a HbS koncentrációjára (18,19,20), és a hemoglobin S nucleációja 50-edik(!) rendű kinetikával megy végbe (21). Ez azt jelenti, hogy már a koncentráció (MCHC) 1%-os csökkenése is kb. 60%-ára csökkenti a folyamat sebességét, miáltal a piracetam hatására kialakuló sejtduzzadás jelentős terápiás haszonnal bírhat. A kedvező terápiás hatást fokozhatják a piracetamnak a vörösvérsejtek endothelhez történő adherenciáját gátló (16), a thrombocyta-aggregációt gátló (22,23), a vörösvérsejtek deformabilitását fokozó hatása (24). A kedvező hatások, kiegészülve azzal, hogy a szernek - a jelenleg elterjedten használt hidroxiureával szemben - nem ismert lényeges mellékhatása, azt mutatják, hogy a piracetam széleskörűen alkalmazható terápiás készítmény lehet sarlósejtes anémiában.
Laboratóriumi szempontból a jelenség azért érdemel figyelmet, mert a már kis mennyiségű, az intravénás kanülből nem megfelelően kimosott piracetam-tartalmú infúziós oldat a vörösvérsejtek duzzadását eredményezi, s ezáltal a helytelenül levett mintáknál tévesen magas MCV értékeket kaphatunk. A jelenség a hasonló esetek többségénél tapasztalható hígító hatásnál összetettebb, felismerését a vörösvérsejtek morfológiai paramétereinek jellegzetes eltérése (emelkedett MCV, csökkent MCHC mellett változatlan MCH) és a páciens korábbi eredményeivel történő összevetés könnyítheti meg.
A kérdés Magyarországon is érvényes klinikai jelentőségét az adja, hogy a piracetamot gyakran alkalmazzák akut stroke-ban, ahol a betegek halálozásának egyik legfontosabb oka az agy-ödéma. Ha a piracetam sejtduzzadást kiváltó hatása nem specifikus a vörösvérsejtekre, hanem más sejteken is érvényesül, akkor fokozhatja az agyödémát, és a gyógyszer kedvező rheológiai hatásai mellett is növelheti a halálozást. A piracetam hatásának ellentmondásos voltára hívja fel a figyelmet a PASS (Piracetam in Acute Stroke Study) tanulmány is (1,25), melynek eredményeit kielégítően magyarázná meg a piracetam agy-ödéma fokozó hatása.
Ezúton szeretnénk köszönetet mondani dr. Homorné Sántha Annának (Prodia Halas Labor Kft. Kiskunhalas), dr. Bocskai Edit főorvosnőnek (Bethesda Gyermekkórház Központi Laboratórium, Budapest), dr. Nagy Éva főorvosnőnek (Csongrád Megye Területi Kórháza, Központi Laboratórium, Szentes) és dr. Salgó László főorvos úrnak (Szeged MJVÖ. II. Kórház Központi Laboratórium), hogy az általuk vezetett laboratóriumokban a mérések elvégzését számunkra lehetővé tették. Dr. Tombácz Attilának és Varga Mihálynak, az Abbott Laboratories Magyarország Kft. munkatársainak köszönjük értékes segítségüket és tanácsaikat.
Szintén ezúton kívánjuk megköszönni az MLDT-Heintel Alapítvány támogatását, melyet a cikk anyagának poszter formájában történő bemutatását támogatta a firenzei IFCC WorldLab kongresszuson.
De Deyn PP, De Reuck J, Deberdt W, et al.: Treatment of Acute Ischemic Stroke with Piracetam. Members of the Piracetam in Acute Stroke Study (PASS) Group Stroke 1997; 28: 2347-2352
De Reuck J, Van Vleymen B: The clinical safety of high-dose piracetam - its use in the treatment of acute stroke Pharmacopsychiatry 1999; 32: Suppl 1; 33-7
Mohandas N, Clark MR, Kissinger S, et al.: Inaccuracies Associated With the Automated Measurement of Mean Cell Hemoglobin Concentration in Dehydrated Cells Blood 1980; 56: 125-128
Nevius DB: Osmotic error In Electronic Determinations of Red Cell Volume Am J Clin Pathol 1963; 39: 38-41
Strauchen JA, Alston W, Anderson J, et al.: Inaccuracy in automated measurement of hematokrit and corpuscular indices in the presence of severe hyperglycemia Blood 1981; 57: 1065-1067
Bock HA, Flückiger R, Berger W: Real and artefactual Erythrocyte Swelling in Hyperglycemia Diabetologia 1985; 28: 335-8
van Duijnhoven HLP, Treskes M: Marked interference of hyperglycemia in measurements of mean (red) cell volume by Technicon H analyzers Clin Chem 1996; 42;1: 76-80
de Melo GO: Piracetam in sickle-cell anaemia [letter] Lancet 1976; 2(7995): 1139-40
de Araujo JT, Nero GS: Piracetam and acetamide in sickle-cell disease Lancet 1977; 2(8034): 411
el-Hazmi MA, Warsy AS, al-Fawaz I, et al.: Piracetam is useful in the treatment of children with sickle cell disease Acta Haematol 1996; 96(4): 221-6
Bick RL, Skondria V, Nix K: Prophylaxis of sickle-cell vaso-active crises with oral piracetam Blood 1981; 58 (Suppl 1): 56a(abstr)
Akeson SP, Mel HC: Deformability and other rheological interactions of red blood cells in electronic cell sizing Biorheology 1986; 23(1): 1-15
Paterakis GS, Laoutaris NP, Alexia SV, et al.:. The effect of red cell shape on the measurement of red cell volume. A proposed method for the comparative assesment of this effect among various haematology analysers Clin Lab Haematol 1994; 3: 235-45.
Asakura T, Ohnishi ST, Adachi K, et al: Effect of piracetam on sickle erythrocytes and sickle hemoglobin Biochim Biophys Acta 1981; 668: 397-405
Jones AR, Twedt D, Swaim W, et al.: Diurnal change of blood count analytes in normal subjects Am J Clin Pathol 1996; 106(6): 723-727
Nalbandian RM, Henry RL, Burek CL, et al.: Diminished Adherence of Sickle Erythrocytes to Cultured Vascular Endothelium by Piracetam Am J Hematol 1983; 15: 147-151
Costa FF, Zago MA, Boltura C: Effects of piracetam and iodoacetamide on erythrocyte sickling Lancet 1979; 2(8155): 1302
Corbett JD, Mickols WE, Maestre MF: Effect of hemoglobin concentration on nucleation and polymer formation in sickle red blood cells J Biol Chem 1995; 270(6): 2708-15
Brugnara C: Erythrocyte dehydration in pathophysiology and treatment of sickle cell disease Curr Opin Haematol 1995; 2: 132-138
Poillon WN, Kim BC, Castro O: Intracellular Hemoglobin S Polymerization and the Clinical Severity of Sickle Cell Anemia Blood 1998; 91: 1777-83
Cao Z, Ferrone FA: A 5Oth order reaction predicted and observed for sickle hemoglobin nucleation J Mol Biol 1996; 256(2): 219-22
Bick RL: In-vivo platelet inhibition by piracetam Lancet 1979; 2(8145): 752-3
Stockmans F, Deberdt W, Nyström A, et al.: Inhibitory Effect of Piracetam on Platelet-rich Thrombus Formation in an Animal Model Thromb Haemost. 1998; 79 (1): 222-7
Gini EK, Sonnet J: Use of piracetam improves sickle cell deformability in vitro and in vivo J Clin Pathol 1987; 40(1): 99-102
Lees KR: Does neuroprotection improve stroke outcome? Lancet 1998; 351: 1447-48
* Levélcím: Márky-Zay János
5700 Gyula, Semmelweis u. 1
e-mail:mzjamos@bioch.szote.u-szeged.hu